
|
Ответы к упражнениям § 39. Химия 8 класс.
Упражнение: 1
 Выберите сильное основание: а) NH3 • H2O; б) Cu(OH)2; в) KOH;
Выберите сильное основание: а) NH3 • H2O; б) Cu(OH)2; в) KOH;
 Сильное основание КОН – щелочь α → 1 Сильное основание КОН – щелочь α → 1
|
Упражнение: 2
 Дайте характеристику гидроксида бария, используя различные признаки классификации оснований.
Дайте характеристику гидроксида бария, используя различные признаки классификации оснований.

| Формула |
Ва(ОН)2 |
| Растворимость в воде |
Растворимое |
| Степень электролитической диссоциации |
Щелочь α → 1 |
| Кислотность |
Двухкислотное основание |
|
Упражнение: 3
 Закончите молекулярные уравнения возможных реакций, запишите соответствующие им ионные уравнения:
а) P2O5 + KOH(изб) →
Закончите молекулярные уравнения возможных реакций, запишите соответствующие им ионные уравнения:
а) P2O5 + KOH(изб) →
б) Fe(OH)2 + HNO3(изб) →
в) (NH4)2SO4 + NaOH(изб) →
г) Ca(OH)2(изб) + CO2 →
д) Ba(OH)2 + Fe(NO3)3 →
е) KOH + NaNO3 →
ж) Mg(OH)2 + FeO →
з) CuOH →
Если реакция не будет протекать, укажите причину этого.

а) P2O5 + 6KOH(изб) = 2K3PO4 + 3H2O
P2O5 + 6K+ +6OH − = 6K+ + 2PO43− + 3H2O
P2O5 + 6OH − = 2PO43− + 3H2O
б) Fe(OH)2 + 2HNO3(изб) = Fe(NO3)2 + 2H2O
Fe(OH)2 + 2H+ + 2NO(изб)− = Fe2+ + 2NO3− + 2H2O
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
в) (NH4)2SO4 + 2NaOH(изб) = Na2SO4 + 2NH3↑ + 2H2O
2NH4+ + SO42− + 2Na+ + 2OH − = 2Na+ + SO42− + 2NH3↑ + 2H2O
2NH4+ + 2OH − = 2NH3↑ + 2H2O
г) Ca(OH)2(изб) + CO2 = CaCO2↓ H2O
Ca2+ + 2OH − + CO2 = CaCO2↓ H2O
д) 3Ba(OH)2 + 2Fe(NO3)3 = 3Ba(NO3)2 + 2 Fe(OH)3↓
3Ba2+ + 6OH − + 2Fe3+ +6NO3− = 3Ba2+ +6NO3−+ 2 Fe(OH)3↓
6OH − + 2Fe3+ = 2 Fe(OH)3↓
е) KOH + NaNO3 = KNO3 + NaOH
K+ +OH − + Na + + NO3 − = K + + NO3 − + Na + + OH −
K+ + OH − + Na+ + NO3 − = K+ + NO3 − + Na+ + OH −
Реакция не идет до конца так как: не образуется вода, не выделяется газ, не выпадает осадок.
ж) Mg(OH)2 + FeO ≠ Реакция не идет так как гидроксиды металлов не взаимодействуют с оксидами металлов
з) 2CuOH = Cu2O + H2O
|
Упражнение: 4
 Вычислите объем аммиака (н.у.), который выделиться при взаимодействии 890 г нитрата аммония, содержащего 20% примесей, с раствором гидроксида натрия. Солько граммов 20%-го раствора щелочи потребуется для реакции?
Вычислите объем аммиака (н.у.), который выделиться при взаимодействии 890 г нитрата аммония, содержащего 20% примесей, с раствором гидроксида натрия. Солько граммов 20%-го раствора щелочи потребуется для реакции?

Дано:
NH4NO3, NaOH
m(смеси)= 890 г
ω( примеси) = 0,2
ω( NaOH) = 0,2
V(NH4NO3) =?
m(щелочи) = ?
|
Решение:
m(NH4NO3) = m(смеси) • ω( NH4NO3) =
= m(смеси) • (1 − ω( примеси))
m(Mg) = 890 • (1 − 0,2) = 712 г
M(NH4NO3) = 14+ 1•4 + 14 + 16•3 = 80 г / моль
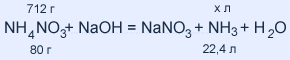
712 : 80 = х : 22,4; х = 199,36 л аммиака
M(NaOH) = 23 + 16 + 1 = 40 г / моль
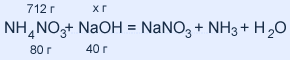
712 : 80 = х : 40 х = 356 г (NaOH)
В 100г раствора содержится 20 г NaOH
В х г раствора содержится 356 г NaOH
100 : х = 20 : 356; х = 1780 г или 1,789кг раствора
Ответ: V(NH3) = 199,36 л. аммиака, 1780г 20% раствора щелочи потребуется для реакции.
|
|
|
Упражнение: 5
 Запишите формулы оксидов, которые будут соответствовать следующим гидроксидам: Cu(OH)2, CuOH, Fe(OH)3, Fe(OH)2. NaOH.
Запишите формулы оксидов, которые будут соответствовать следующим гидроксидам: Cu(OH)2, CuOH, Fe(OH)3, Fe(OH)2. NaOH.

| Гидроксид |
Соответствующий оксид |
| Cu+2 (OH)2 |
Cu+2O−2 |
| Cu+1OH |
Cu2+1O−2 |
| Fe+3 (OH)3 |
Fe2 +3O3 −2 |
| Fe+2 (OH)2 |
Fe+2O−2 |
| Na+1OH |
Na2+1O−2 |
|
|