
|
Ответы к упражнениям § 40. Химия 8 класс.
Упражнение: 1
 Из перечня формул выпишите отдельно формулы основных и кислотных оксидов и запишите соответствующие им формулы оснований и кислот: SiO2, CrO3, MgO, Mn2O7, Cu2O, SO2, FeO, N2O3, K2O, NiO, Na2O, NO, BaO. Назовите все вещества.
Из перечня формул выпишите отдельно формулы основных и кислотных оксидов и запишите соответствующие им формулы оснований и кислот: SiO2, CrO3, MgO, Mn2O7, Cu2O, SO2, FeO, N2O3, K2O, NiO, Na2O, NO, BaO. Назовите все вещества.

| Кислотные оксиды |
Кислоты |
Si+4O2
оксид кремния |
H2Si+4O3
кремниевая кислота |
Cr+6O3
оксид хрома(VI) |
H2Cr+6O4
хромовая кислота |
Mn+72O7
оксид марганца (VII) |
HMn+7O4
марганцевая кислота |
S+4O2
оксид серы (IV) |
H2S+4O3
сернистая кислота |
N+32O3
оксид азота (III) |
HN+3O2
азотистая кислота |
N+2O
оксид азота(II) |
несолеобразующий оксид |
|

| Основные оксиды |
Основания |
Mg+2O
оксид магния |
Mg+2(OH)2
гидроксид магния |
Cu2+1O
оксид меди (I) |
Cu+1OH
гидроксид меди (I) |
Fe+2O
оксид железа (II) |
Fe+2(OH)2
гидроксид железа (II) |
K2+1O
оксид калия |
K+1OH
гидроксид калия |
Ni+2O
оксид никеля (II) |
Ni+2(OH)2
гидроксид никеля (II) |
Na2+1O
оксид натрия |
Na+1OH
гидроксид натрия |
Ba+2O
оксид бария |
Ba+2(OH)2
гидроксид бария |
|
Упражнение: 2
 Дайте характеристику химических свойств оксида серы (IV). Запишите уравнения характерных реакций.
Дайте характеристику химических свойств оксида серы (IV). Запишите уравнения характерных реакций.

S+4O2 оксид серы (IV)
Солеобразующий, кислотный оксид, ему соответствует сернистая кислота H2S+4O3
1. SO2 + NaOH = Na2SO3 + H2O
2. SO2 + K2O = K2SO3
3. SO2 + H2O = H2SO3
|
Упражнение: 3
 Допишите уравнения возможных химических реакций.
Допишите уравнения возможных химических реакций.
а) Fe2O3 + H2O →
б) KOH(изб) + P2O5 →
в) BaO + HNO3 →
г) CaO + SiO2 →
д) Na2O + N2O5 →
е) N2O + NaOH →
Если реакция не протекает, укажите причину.
|

а) Fe2O3 + H2O ≠ реакция не идет так как Fe(OH)3 – нерастворимое основание
б) 6KOH(изб) + P2O5 = 2K3PO4 + 3H2O
в) BaO + 2HNO3 =Ba(NO3)2 + H2O
г) CaO + SiO2 = CaSiO3
д) Na2O + N2O5 = 2NaNO3
е) N2O + NaOH ≠ реакция не идет так как N2O – несолеобразующий оксид
|
Упражнение: 4
 В 420 мл воды растворили 40 г оксида серы (VI). Вычислите массовую долю серной кислоты в полученном растворе.
В 420 мл воды растворили 40 г оксида серы (VI). Вычислите массовую долю серной кислоты в полученном растворе.

Дано:
SO3, H2O
V(H2O) = 420 мл
m(SO3 )= 40 г
ρ( H2O) = 1 г/мл
ω(H2SO4) =?
|
Решение:
1. Определим массу H2SO4 в полученном растворе:
M(SO3) = 32 + 16•3 = 80 г / моль
M(H2SO4) = 1 •2 + 32 + 16 •4 = 98 г / моль
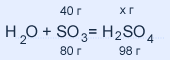
40 : 80 = х : 98 х = 49 г. серной кислоты в полученном растворе
2. Определим массу раствора:
mр-ра = m(H2O) + m(SO3)
m(H2O) = V(H2O) • ρ (H2O) = 420 • 1 = 420 г
mр-ра = 420 + 40 = 460 г раствора
4.Определим массовую долю серной кислоты в полученном растворе:
ω(H2SO4) = m(H2SO4) : mр-ра = 49 : 460 = 0,106 или 10,7 %
Ответ: ω(H2SO4) = 0,106 или 10,7 %
|
|
|
Упражнение: 5
 Вычилите объем углекислого газа (н.у.), который образуется при обжиге 500 г известняка, содержащего 20% примесей. Вычислите количество вещества оксида кальция, образующегося при этом.
Вычилите объем углекислого газа (н.у.), который образуется при обжиге 500 г известняка, содержащего 20% примесей. Вычислите количество вещества оксида кальция, образующегося при этом.

Дано:
CaCO3
mсмеси= 500 г
ωпримеси = 0,2
V(CO2) =?
n = (CaO) =?
|
Решение:
m(CaCO3) = mсмеси • ω( CaCO3) =
= mсмеси • (1 − ωпримеси)
m(CaCO3) = 500 • (1 − 0, 2) = 400 г
M(CaCO3) = 40 + 12 + 16 • 3 =100 г / моль
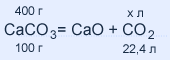
400 : 100 = х : 22,4; х = 89,6 л ≈ 90 л углекислого газа
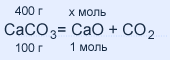
400 : 100 = х : 1 х = 4 моль оксида кальция CaO
Ответ: V(CO2) = 90 л, n = (CaO) = 4 моль
|
|
|
|