
|
Ответы к упражнениям § 41. Химия 8 класс.
Упражнение: 1
 Из перечня формул выпишите отдельно формулы средних, кислых и основных солей, дайте их названия и запишите уравнения их диссоциации:
Из перечня формул выпишите отдельно формулы средних, кислых и основных солей, дайте их названия и запишите уравнения их диссоциации:
Ca(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3.
|
 Средние соли Средние соли
Ca(NO3)2 = Ca2+ + 2NO3− нитрат кльция
Na3PO4 = 3Na + + PO43− фосфат натрия
Кислые соли
Ca(HSO4)2 = Ca2+ + 2HSO4− гидросульфат кальция
NaH2PO4 = Na + + H2PO4 − дигидрофосфат натрия
Основные соли
(CaOH)2SO4 = 2CaOH+ + SO4 2− гидроксосульфат кальция
MgOHNO3 = MgOH + + NO3− гидроксонитрат магния
|
Упражнение: 2
 Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения:
Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения:
а) HCl + Na2SO4 →
б) H3PO4 + CaCl2 →
в) FeCl3 + AgNO3 →
г) KNO3 + NaCl →
д) NaOH+ FeS →
е) KOH + Al2(SO4)3 →
ж) Ca + CuCl2 →
з) Cu + AgNO3 →
и) Mg + ZnS →
к) Cu + Fe(NO3)2 →
Если реакция не может быть осуществлена, объясните почему.

а) 2HCl + Na2SO4 = H2SO4 + 2NaCL
2H+ +2Cl− + 2Na+ + SO42− = 2H+ + SO42− + 2Na+ + 2Cl−
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
б) 2H3PO4 + 3CaCl2 = Ca3(PO4)2↓ + 6HCl
6H+ + 2PO43− + 3Ca2+ 6Cl− = Ca3(PO4)2↓ + 6H+ + 6Cl−
2PO43− + 3Ca2+ = Ca3(PO4)2↓
в) FeCl3 + 3AgNO3 = Fe(NO3)3 + 3AgCl↓
Fe 3+ + 3Cl −+ 3Ag + + 3NO 3 − = Fe 3+ + 3NO 3 − + 3AgCl↓
3Cl −+ 3Ag + = 3AgCl↓
г) KNO3 + NaCl = KCl + NaNO3
K + + 2NO 3 − + Na + + Cl − = K + + Cl − + Na + + NO 3 −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
д) 2NaOH + FeS = Na2S + Fe(OH)2↓
2Na+ + 2OH − + Fe2+ + S2− = 2Na+ + S2− + Fe(OH)2↓
2OH − + Fe2+ = Fe(OH)2↓
е) 6KOH + Al2(SO4)3 = 3K2SO4 + 2Al(OH)3↓
6K+ + 6OH − + 2Al3+ + 3SO42− = 6K+ + 3SO42− + 2Al(OH)3↓
6OH − + 2Al3+ + = 2Al(OH)3↓
ж) Cu + CuCl2 = CaCl2 + Cu
Ca0 + Cu2+ + 2Cl− = Ca 2+ + 2Cl − + Cu 0
Ca0 + Cu2+ = Ca 2+ + Cu 0
з) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Cu0 + 2Ag + + 2NO 3 − = Cu2+ + 2 NO 3 − + 2Ag 0
Cu0 + 2Ag + = Cu2+ + 2Ag 0
и) Mg + ZnS ≠ MgS + Zn Реакция не идет т.к. ZnS и MgS нерастворимые соли
к) Cu + Fe(NO3)2 ≠ Реакция не идет т.к. в электрохимическом ряду напряжений Cu расположена правее Fe и не может вытеснять железо из его солей
|
Упражнение: 3
 В 980 г 5% раствора серной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка.
В 980 г 5% раствора серной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка.

Дано:
H2SO4, Ba(NO3)2
mр-ра= 980 г
ω( H2SO4) = 0,05
mосад. =?
|
Решение:
m(H2SO4) = mр-ра • ω( H2SO4) =
= 980 • 0,05 = 49 г
M(H2SO4) = 1 • 2 + 32 + 16 • 4 = 98 г / моль
M(BaSO4) = 137 + 32 + 16 • 4 = 233г / моль
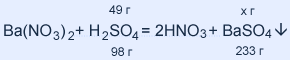
49 : 98 = х : 233; х = 116,5 г BaSO4
Ответ: m(BaSO4) = 116,5 г
|
|
|
Упражнение: 4
 Запишите уравнения реакций всех возможных способов получения сульфата железа (II).
Запишите уравнения реакций всех возможных способов получения сульфата железа (II).

1. Fe + H2SO4 = FeSO4 + H2↑
2. FeO + H2SO4 = FeSO4 + H2O
3. Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
4. CuSO4 + Fe = FeSO4 + Cu
5. FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O
|
Упражнение: 5
 Определите степени окисления элементов в солях, формулы которых: Na2SO4, K2SO3, Fe(NO3)2, Mg(HCO3)2, Ca3PO4)2, NaHSO4, CuOHNO3.
Дайте названия солей.
Определите степени окисления элементов в солях, формулы которых: Na2SO4, K2SO3, Fe(NO3)2, Mg(HCO3)2, Ca3PO4)2, NaHSO4, CuOHNO3.
Дайте названия солей.

Na+12S+6O−24 - Сульфат натрия
K+12S+4O−23 - Сульфит калия
Fe+2 (N+5O3−2)2 - Нитрат железа (II)
Mg+1 (H+1C+4O−23)2 - Гидрокарбонат магния
Ca+23P+5O−24)2 - Фосфат кальция
Na+1H+1S+6O−24 - Гидросульфат натрия
Cu+2O−2H+1N+5O−23 - Гидроксонитрат меди(II)
|
|